
Connaissez-vous leur potentiel en ophtalmologie?
Quelles sont vos principales préoccupations au sujet de l’utilisation des biosimilaires?
Cliquez sur les aspects suivants pour en savoir plus.
Se familiariser avec les médicaments biosimilaires
Biosimilaires par rapport aux médicaments biologiques de référence
Les biosimilaires sont des médicaments biologiques qui sont très semblables à leurs médicaments biologiques de référence. Il n’y a aucune différence d’importance clinique entre les biosimilaires et les médicaments de référence homologués en ce qui concerne les aspects suivants 1 :
|
Innocuité |
|
Pureté |
|
Puissance |
Les biosimilaires sont homologués par Santé Canada en fonction d’une comparaison approfondie avec les médicaments de référence, et peuvent seulement faire leur entrée sur le marché une fois que les brevets et les protections des données des médicaments biologiques de référence sont expirés 1.

Les biosimilaires ne sont PAS des médicaments génériques 1
Les médicaments génériques sont des médicaments chimiques à petites molécules qui contiennent les mêmes ingrédients médicinaux que les produits de référence.
Les médicaments biologiques et les biosimilaires sont des médicaments à grosses molécules complexes qui proviennent de cellules vivantes et qui sont donc naturellement variables.
Processus de fabrication des biosimilaires
La fabrication des biosimilaires répond aux mêmes normes réglementaires qui régissent la fabrication des autres médicaments biologiques. Ils sont très semblables, mais pas identiques, et leurs processus de fabrication sont indépendants 1.
Les biosimilaires affichent un faible degré de variabilité intrinsèque qui fait l’objet d’un contrôle strict 2.
|

Teva Canada s´engage à ce que tout biosimilaire que nous commercialisons et fabriquons soit produit dans des installations ultramodernes avec des agents de la plus haute qualité.
La fourchette de variabilité autorisée pour les biosimilaires est la même que pour les médicaments de référence.
Nous sommes résolus à tirer profit de notre expérience bien établie et reconnue en matière de fabrication et d’approvisionnement de médicaments par des investissements pour la mise au point de biosimilaires au Canada.
Faire passer les patients d’un médicament biologique de référence à un médicament biosimilaire
La substitution d’un médicament à un autre signifie généralement le passage de l’utilisation systématique d’un médicament biologique de référence à l’utilisation d’un biosimilaire 1, 3.
Selon Santé Canada, les patients et les professionnels de la santé peuvent se fier à l’efficacité et à l’innocuité des biosimilaires pour toutes leurs indications autorisées 1, 3.
Une grande majorité des études menées sur les patients ayant effectué une seule substitution n’ont pas signalé de différences en matière d’efficacité, d’innocuité et d’immunogénicité par rapport aux patients qui n’ont pas fait de substitution 4.
Selon Santé Canada, la décision de passer à un autre médicament doit être prise par le médecin traitant, en consultation avec le patient et en prenant en compte les éléments suivants 3 :
- Les données cliniques disponibles
- Toute politique de l’autorité compétente

Politique de passage aux biosimilaires
Les récents changements apportés aux politiques visant à promouvoir le passage aux biosimilaires devraient se traduire par d’importantes réductions de coûts pour les catégories visées de médicaments biologiques au Canada. Ces démarches devraient aider à atténuer la pression exercée par les médicaments plus coûteux dans les années à venir 5.
Les biosimilaires sur le marché canadien
L’utilisation des biosimilaires continue de croître au Canada 6;
- Plus de 50 biosimilaires sont approuvés pour la vente au Canada.
- Plus de 1,77 million d’ordonnances de biosimilaires sont exécutées annuellement par des pharmacies de détail.
- L’expiration des brevets offre une occasion de mettre au point davantage de biosimilaires.
Les biosimilaires contribuent à la durabilité du système de santé en 3 :
|
Chez Teva, nous savons que les biosimilaires offrent aux Canadiens des occasions et des bienfaits significatifs. C’est pourquoi nous continuons d’axer nos efforts en matière de recherche et de développement sur la mise au point de biosimilaires fiables pour les consommateurs et les fournisseurs.
Programmes de soutien aux patients qui prennent des biosimilaires

Teva Support SolutionsMD est un programme complet qui fournit des services de soutien aux patients et aux prescripteurs de biosimilaires de Teva.
Les fabricants de biosimilaires sont déterminés à limiter les répercussions de la substitution sur les patients et les prescripteurs. Ils ont donc mis en place des programmes de soutien aux patients (PSP) qui offrent des procédures et des services semblables à ceux offerts par les programmes des médicaments biologiques d’origine afin d’assurer une transition harmonieuse.
Les programmes de soutien aux patients peuvent offrir un éventail de services, y compris les suivants :
- Soutien infirmier
- Exploration des options de remboursement
- Pharmacovigilance continue
Processus d'homologation des biosimilaires
Santé Canada a élaboré un cadre réglementaire solide et basé sur la science pour l'homologation des biosimilaires.
Grâce à ces normes d'homologation rigoureuses, les patients et les professionnels de la santé peuvent accorder autant de confiance aux biosimilaires qu’à leurs médicaments biologiques de référence en ce qui concerne les aspects suivants 1, 5 :
|
Innocuité |
|
Pureté |
|
Puissance |
Comment la similarité entre un biosimilaire et un médicament biologique de référence est-elle démontrée à Santé Canada?
La similarité est démontrée par des études de comparaison fondées sur une approche par étape :
1. Études structurales et fonctionnelles
2. Études cliniques menées chez des humains
Étant donné que ces études visent à démontrer la similarité, le type de données requis pour appuyer l’autorisation d’un médicament biosimilaire diffère de celui requis pour un médicament biologique autonome 1.
Cadre réglementaire du médicament biologique de référence par rapport au médicament biosimilaire1
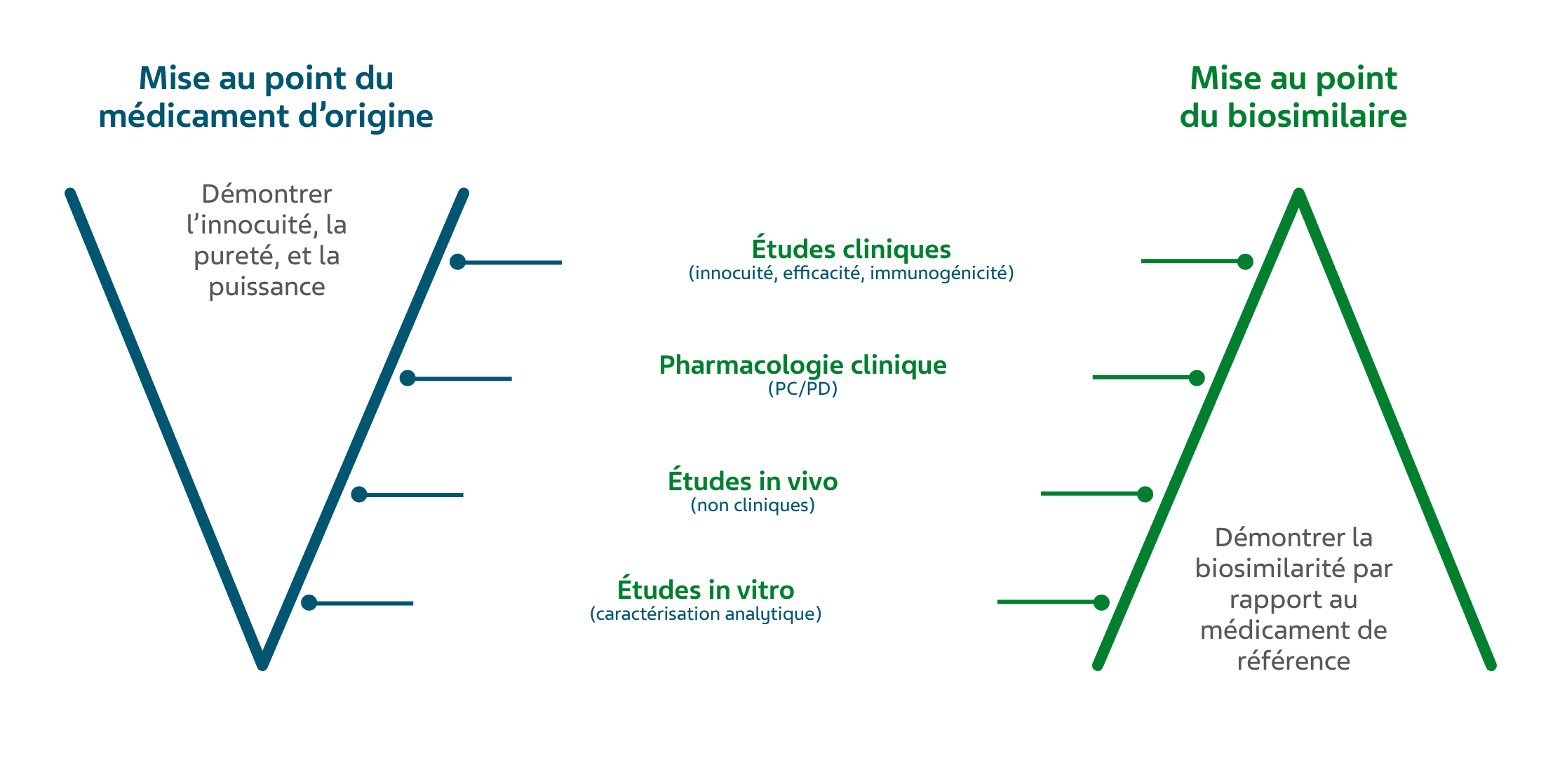
PC : pharmacocinétique; PD : pharmacodynamique

Les fabricants doivent démontrer de manière indépendante la similarité entre le biosimilaire et le médicament biologique de référence déjà autorisé en matière de structure, de fonction, d’efficacité et d’innocuité 1.
Références :
-
Back to contents.
Gouvernement du Canada. Médicaments biologiques biosimilaires au Canada : Fiche d’information. Disponible au https://www.canada.ca/content/dam/hc-sc/migration/hc-sc/dhp-mps/alt_formats/pdf/brgtherap/applic-demande/guides/Fiche-renseignements-2019-08-23.pdf. Consulté le 26 mai 2023.
-
Back to contents.
Biosimilaires Canada. Chapitre 4. Les médicaments biosimilaires – l’excellence scientifique en action. Disponible au https://biosimilairescanada.ca/ressources/biosimilaires-101/. Consulté le 5 juin 2023.
-
Back to contents.
Edwards S, et al. Primer on biosimilars. Disponible au https://careeducation.ca/wp-content/uploads/2019/06/biosimilarsprimer_final.pdf. Consulté le 26 mai 2023.
-
Back to contents.
Biosimilaires Canada. Chapitre 6. Capitaliser l’expérience et la réussite des médicaments biosimilaires. Disponible au https://biosimilairescanada.ca/ressources/biosimilaires-101/. Consulté le 5 juin 2023.
-
Back to contents.
Gouvernement du Canada. L’évolution du marché des biosimilaires au Canada et ce qu’elle signifie pour les payeurs. Disponible au https://www.canada.ca/content/dam/pmprb-cepmb/documents/npduis/analytical-studies/posters/2022/BiosimilarsInCanada_Poster_FR_ISPOR2022.pdf. Consulté le 26 mai 2023.
-
Back to contents.
Biosimilaires Canada. Transition vers les biosimilaires. Disponible au https://biosimilairescanada.ca/ressources/transition-biosimilaire/. Consulté le 5 juin 2023.
